通讯作者:高晓勤,联系电话:0851-6909610。
作者简介:丁贤胜,男,1979年生,硕士,助教,主要从事男性生殖学方面的研究。
探讨盐酸利多卡因(LHA)体外对人精子形态结构改变的机制。
方法选择健康生育男性8名,年龄23~32岁,禁欲3~7 d后,手淫取精。分为对照组(A组),实验B组(LHA终浓度为5 mg/mL)、实验C组(LHA终浓度为15 mg/mL)。体外孵育1、2 h后,采用S3400N扫描电镜观察各组精子形态的改变。
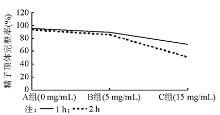
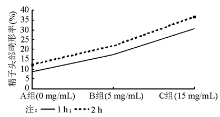
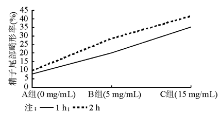
结果与A组相比,实验B组1 h后精子形态结构改变差异无统计学意义( P>0.05),2 h后差异有统计学意义( P<0.05);实验C组1 h后差异有统计学意义( P<0.05),2 h后差异更为明显( P<0.01)。
结论随着LHA终浓度的增加和孵育时间的延长,LHA对精子形态结构改变越来越明显。
To investigate the mechanism of the change of sperm shape after using lidocaine hydrochloric acid (LHA) in vitro.
Methods8 healthy males, whose age was 23-32 years old, and abstinence 3-7 d, were enrolled in the study. The sperm was collected through the masturbation. The specimens were classified into control group A and experiment group B,C. The LHA were added to the experiment groups respectively at the different concentrations. The concentrations were 5 mg/mL and 15 mg/mL respectively. After fostering 1 h and 2 h in vitro,the changes of sperm shape were examined in the group A ,B and C through the scanning electronic microscope S3400N.
ResultsCompared with group A, group B did not show obvious difference after fostering 1 h( P>0.05), but the difference was remarkable after fostering 2 h( P<0.05). Group C showed difference after fostering 1 h( P<0.05),and more remarkable difference after fostering 2 h ( P<0.01).
ConclusionsWith increasing end concentration and extended time,the influence of LHA on the change of sperm shape is more obvious.
盐酸利多卡因(LHA)是一种酰胺类中效局部麻醉药, 以往临床常用于局部麻醉和抗心律失常[1], 随着现代医药技术的提高, 其应用越来越广, 用量也越来越大 [2]。有报道[3, 4], 1 μ g/mL LHA对小鼠2细胞期的胚胎发育产生明显抑制, 且体外高浓度的LHA能明显抑制人精子运动, 显示一定的杀精子作用。在我们的前期研究中, 我们发现LHA可能是现代人类辅助生殖技术成功率低的原因之一, 也有可能作为体外杀精剂进行开发。
8名健康生育男性志愿供精者, 年龄23~32岁, 禁欲时间为3~7d内, 经手淫取得全份精液标本, 分别进行精液常规分析, 结果都符合世界卫生组织(WHO)规定的正常标准。
1%锇酸(唐和唐生物科技有限公司); 3%戊二醛(武汉瑞基化工有限公司); Epon812环氧树脂(沈阳强华试剂厂); 醋酸铀(上海瑞诚化工有限公司); 20 mg/mL LHA(山东华鲁制药有限公司); S3400N扫描电镜(日本日立公司); 计算机辅助精液分析系统(北京伟力新世纪科技发展有限公司); SPX-150C恒温恒湿箱(上海博讯实业有限公司医疗设备厂)。
精液完全液化后实验分组:A组为对照组, 1 mL精液, 不加LHA。B、C组分别将0.25 mL、0.75 mL LHA与适量精液体外共同孵育, LHA终浓度分别为5、15 mg/mL, 总体积均为1 mL, 轻柔混匀后于37 ℃恒温恒湿箱中孵育。
将各组精液标本分别于孵育后1 h、2 h时取出, 用PBS液洗涤3次, 2 000 r/min离心(离心半径8 cm), 每次10 min, 3%戊二醛固定3 h, PBS洗涤3次, 2 000 r/min(离心半径8 cm)离心, 每次15 min, 1%锇酸再固定0.5 h, PBS洗涤3次, 2 000 r/min(离心半径8 cm)离心, 每次15 min, 乙醇梯度脱水, 100%的醋酸异戌酯置换乙醇3次, 每次10 min, 用吸管吸取管底液2~3滴, 滴到盖璃片上涂片, JEE-5B真空冷冻干燥机干燥, 离子溅射仪喷金, 用S3400N扫描电镜观察, 每个标本观察50~100个精子。
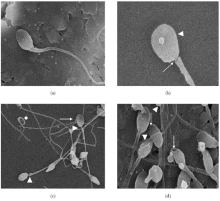
1. 精子头部形态 正面观呈卵圆形, 侧面观呈梨形, 边界清楚, 边缘整齐, 局部无隆起, 无颗粒黏附, 顶体饱满, 不出现变扁和凹陷。
2. 精子尾部 尾部自然弯曲, 无断裂, 无线粒体鞘肿胀或缺损。
采用SPSS11.5统计软件包进行统计分析, 结果以
A组可见到正常形态的精子。实验组出现各式各样的精子形态学改变, 精子的头部、颈部和尾部均可发生形态异常, 且随着孵育时间的延长, 精子形态改变更加明显, 特别是实验B组孵育2 h后以及实验C组更加明显, 见表1、图1~4。
| 表1 不同浓度LHA与精子孵育后扫描电镜检测结果( |
精子形态结构与精子的功能活动密切相关。电镜是目前精子形态学检测最客观可信的依据[5]。应用扫描电镜对精子形态进行观察, 可以了解精子表面的结构细节, 阐明光镜未能观察到的精子超微病理缺陷, 有助于某些男性不育患者的精子病因学分析[6~8]。
本研究用不同终浓度LHA体外作用于精液标本, 通过扫描电镜观察其对人精子形态结构改变的情况, 希望能为人类辅助生殖技术、开发新型体外杀精剂和指导临床用药提供理论依据。结果发现, 与A组孵育1 h的结果相比, B组孵育1 h结果差异无统计学意义(P> 0.05), C组孵育1 h结果差异更为明显(P< 0.05); 与A组孵育2 h的结果相比, B组孵育2 h结果差异有统计学意义(P< 0.05), 而C组孵育2 h结果差异更为明显(P< 0.01)。随着LHA终浓度的增高和孵育时间的延长, 精子头部肿胀、变扁甚至凹陷、颈部肿胀甚至断裂增加, 这与本课题组前期研究中精子透明质酸酶阳性率及活性强度改变的结果相似, 推测可能是由于精子膜受损, 顶体透明质酸酶通过受损的精子膜丢失所致。
LHA是一种酰胺类中效局部麻醉药, 可在细胞膜中溶解而引起膜膨胀, 从而使蛋白质与膜脂质相关结构之间的构型发生改变, 使离子通道的功能发生部分性障碍[9, 10]。因此阻碍Na+通过, 钠泵受到抑制, 细胞内Na+不能有效地转运到细胞外, 渗透压的调节和电子等物质的跨膜转运等功能受阻, 导致细胞内高渗状态和pH值降低等。这样, 当LHA低浓度作用下, 胞膜膨胀、受损; 当高浓度和孵育时间延长时, 胞膜膨胀、受损更加严重。而顶体内含有大量的酶, 重要的有顶体蛋白酶、透明质酸酶等[11], 当胞膜膨胀受损严重时, 顶体内容物可能通过受损的胞膜丢失[12, 13]。这样, 在扫描电镜下可以观察到精子头部变扁, 当顶体内容物丢失多时, 甚至出现凹陷, 但具体精子顶体结构的改变有待于进行进一步的研究。
另外, 胞内pH值降低将导致胞内系列酶活性受到抑制, 如透明质酸酶、顶体蛋白酶、酸性磷酸酶及由DNA编码的系列酶等。精子内系列酶受到抑制, 将导致胞内代谢紊乱, 这样可能出现精子超微结构改变和胞膜结构不稳定。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|