作者简介:唐玲丽,女,1971年生,博士,副主任技师,主要从事代谢性疾病研究。
通讯作者:周后德,联系电话:0731-85292151。
观察胰岛素受体底物-1(IRS-1)基因表达受阻对小鼠3T3-L1前脂肪细胞分化和脂质过氧化物酶体增殖物激活受体γ(PPARγ)表达的影响。
方法针对小鼠IRS-1基因开放阅读框上的2个区域合成短发夹核糖核酸[shRNA(M和MH)],以pGenesil-1 vector为载体构建带绿色荧光蛋白(GFP)靶标的shRNA质粒。以脂质体LipofectaminTM2000介导转染3T3-L1前脂肪细胞,并设阴性对照(HK)载体转染组。细胞转染后,G418筛选稳定表达的阳性克隆并通过免疫印迹法鉴定。应用0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、10-6 mol/L地塞米松(DEX)和5 μg/mL胰岛素(Ins)分别诱导小鼠3T3-L1前脂肪细胞空白对照组、HK载体转染组、M和MH转染组分化,在诱导分化的不同时间点收集细胞。用免疫印迹法检测PPARγ的表达。脂肪细胞内脂滴用油红O染色观察。
结果与空白对照组、HK组和转染M组IRS-1 shRNA质粒的3T3-L1前脂肪细胞相比,转染MH组IRS-1 shRNA质粒的3T3-L1前脂肪细胞IRS-1蛋白表达水平降低70%以上;而MH转染组细胞PPARγ蛋白的表达与前3组3T3-L1前脂肪细胞比较无改变。前3组3T3-L1前脂肪细胞诱导分化为成熟脂肪细胞成功,PPARγ蛋白的表达在脂肪细胞分化成熟过程中逐渐增高。油红O染色显示,随着脂肪细胞的分化成熟,桔红色脂滴逐渐增多;而转染MH组IRS-1 shRNA质粒的3T3-L1前脂肪细胞经诱导,油红O染色桔红色脂滴显着减少,直到分化的第8天,才见少许桔红色脂滴,且PPARγ蛋白的表达无变化。
结论IRS-1基因沉默后可抑制3T3-L1前脂肪细胞的分化,并在分化过程中抑制PPARγ的表达,说明IRS-1通过调节PPARγ的表达或与PPARγ共同作用在3T3-L1前脂肪细胞的分化中发挥决定性作用。
To observe the influence of insulin receptor substrate-1 (IRS-1) gene silencing on the differentiation of mouse 3T3-L1 preadipocytes and peroxisome proliferator-activated receptor γ (PPARγ) expression.
MethodsTwo short hairpin RNA (shRNA M and shRNA MH) target to IRS-1 gene coding region were designed and cloned into pGenesil-1-shRNA vector with green fluorescence protein (GFP) tag. The pGenesil-1-IRS-1-shRNA plasmids were stably transfected into 3T3-L1 preadipocytes by LipofectaminTM2000, and negative control transfected group (HK) was set. The positive clones were screened by G418 and identified through measuring IRS-1 protein by Western blot. 3-isobutyl-1-methylxanthine (IBMX) (0.5 mmol/L),dexamethasone (DEX) (10-6 mol/L) and insulin (Ins) (5 μg/mL) were applied into inducing the differentiation of 3T3-L1 preadipocytes in control group, HK control group, M group and MH group. The expression of PPARγ was determined by Western blot. The lipid droplets of 3T3-L1 preadipocytes were observed by Oil-Red O staining.
ResultsThe expression of IRS-1 protein of 3T3-L1 preadipocytes transfected with IRS-1 shRNA plasmid in MH group significantly decaeased 70% compared with the control group, HK control group and M group. The expression of PPARγ had no change compared with other 3 groups. IRS-1 gene silencing did not affect the expression of PPARγ protein in uninduced 3T3-L1 preadipocytes, but decreased the expression of PPARγ protein during the in vitro induced differentiation of 3T3-L1 preadipocytes. The lipid droplets count was reduced by Oil-Red O staining.
ConclusionsThe silencing of the IRS-1 gene inhibits the differentiation of 3T3-L1 preadipocytes, and suppresses the expression of PPARγ protein in the differentiation of 3T3-L1 preadipocytes. IRS-1 plays an important role by regulating the expression of PPARγ protein in the differentiation of 3T3-L1 preadipocytes.
肥胖已成为全球瞩目的流行病之一, 肥胖伴随有很多严重威胁人们健康的并发症, 如2型糖尿病、心血管疾病、高血压和癌症等[1]。肥胖的发生受遗传和环境的影响, 而其病理基础是脂肪细胞的分化。脂肪细胞的分化受许多因素的调节。在其分化过程中, 有许多转录因子参与到转录级联反应中。其中, 脂质过氧化物酶体增殖物激活受体γ (peroxisome proliferators-activated receptor γ , PPARγ )对脂肪细胞的分化尤其重要[2]。近年来的研究表明, 胰岛素受体底物(insulin receptor substance, IRS )家族对体内脂肪的生成以及脂肪细胞的分化至关重要[3~5]。体外进行肥胖研究主要是用小鼠3T3-L1或3T3-F442A前脂肪细胞作为模型。我们的前期研究发现, 在运用经典的鸡尾酒和胰岛素诱导3T3-1前脂肪细胞分化成熟过程中, IRS-1 mRNA和蛋白质的表达都呈上升的趋势, 且与脂滴分泌量的变化一致。说明IRS-1在白色脂肪的形成中具有重要作用, 但其具体作用机制尚未明了。因此, 我们应用短发夹核糖核酸(shRNA)干扰技术沉默小鼠3T3-L1前脂肪细胞IRS-1基因的表达, 研究IRS-1基因沉默后的3T3-L1前脂肪细胞分化和PPARγ 表达的变化, 以探索IRS-1在脂肪细胞分化中的作用及其机制。
高糖达尔伯克氏必需基本(DMEM)培养基和胎牛血清(FBS)购自Gibico公司; 胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)和地塞米松(dexamethasone, DEX)购自美国Sigma公司; 脂质体LipofectaminTM 2000购自美国Invitrogen公司; 优化必需基本(Opti-MEM)培养基购自美国Hyclone公司; 所有的抗体购自美国Santa Cruz公司; 鼠3T3-L1前脂肪细胞购自美国标准生物品收藏中心(ATCC)(CL-173)。
1.RNA干扰 针对小鼠IRS-1基因开放阅读框上的2个区域(分别为1135-1155和1429-1447)合成shRNA, 其中1135-1155位点为小鼠特有的序列, 合成的shRNA为M组, 而1429-1447位点为人和鼠共有的保守序列, 合成的shRNA为MH组。以pGenesil-1 vector为载体构建带绿色荧光蛋白(green fluorescence protein, GFP)靶标的shRNA质粒。以脂质体LipofectaminTM2000介导转染3T3-L1前脂肪细胞, 并设阴性对照(HK)载体转染组。依据操作手册进行细胞转染, 细胞转染后, G418筛选稳定表达的阳性克隆, 并通过测定IRS-1和GFP蛋白确定干扰效果。
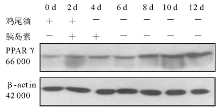
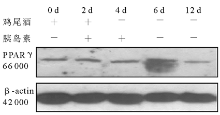
2.细胞培养和分化 3T3-L1前脂肪细胞在含10% FBS的高糖DMEM培养液(含100 U/mL青霉素、100 U/mL链霉素)中生长至接触抑制2 d后, 按下述诱导分化方案进行诱导:将生长抑制2 d(Day 0)的3T3-L1前脂肪细胞(HK组、M组和MH组)用含有10% FBS、0.5 mmol/L IBMX, 10-6mol/L DEX、5 μ g/mL 胰岛素的高糖DMEM培养液(鸡尾酒)诱导2 d(Day 2)后, 换含有10% FBS、5 μ g/mL 胰岛素的高糖DMEM培养液继续培养2 d(Day 4)。此后每隔1 d更换含10% FBS的高糖DMEM培养液, 分别于培养的第0、2、4、6、8、10、12天(M组和HK组)和第0、2、4、6、12天(MH组)抽提细胞总蛋白。
3.免疫印迹 参照分子克隆实验指南。取40 μ g细胞总蛋白与6× 十二烷基磺酸钠(SDS)加样缓冲液混匀, 100 ℃加热蛋白变性5 min, 点样于10% SDS-聚丙稀酰胺凝胶 (SDS-PAGE)中电泳。将聚偏氟乙烯(PVDF)膜在甲醇中平衡10 min, 在转移缓冲液中平衡10 min, 将滤纸和SDS-PAGE在转移缓冲液中平衡10 min。按滤纸-凝胶-PVDF膜-滤纸顺序叠放, 凝胶靠近负极, 膜朝向正极, 除尽各层之间气泡。于4 ℃冷库恒压(66 V)电泳转移 3 h, 取出PVDF膜, 用含5%脱脂奶粉的磷酸盐缓冲液(PBS)-吐温室温封闭1 h或4 ℃冷库过夜。用含兔抗IRS-1抗体(1∶ 1 000稀释)、兔抗PPARγ 抗体(1∶ 500稀释)、鼠抗GFP抗体(1∶ 1 000稀释)的PBS室温孵育2 h, PBS-吐温洗膜10 min× 3次。用含辣根过氧化物酶标记抗兔抗鼠二抗(1∶ 5 000稀释)的PBS室温孵育1 h, PBS-吐温洗膜10 min× 3次, 洗膜后增强型化学发光(ECL)自显影, 洗片显带。同一张膜洗脱后, 用1∶ 10 000稀释的鼠抗β -肌动蛋白(β -actin)一抗, 辣根过氧化物酶标记抗鼠二抗(1∶ 5 000稀释)重新杂膜, 发光自显影, 洗片显带作为内对照。所有杂交信号在成像分析仪系统测定条带密度。IRS-1和PPARγ 蛋白的表达水平以IRS-1/β -actin和PPARγ /β -actin的吸光度(A)比值表示。以上实验均重复3次。
4.油红O染色 各组3T3-L1前脂肪细胞传代于放置无菌波片的6孔板中, 细胞按上述诱导分化方案进行诱导, 分别于培养的第8天对细胞进行油红O染色。0.5%油红O贮存液(溶于异丙醇)用水按3∶ 2稀释。弃去培养孔中的培养基, PBS冲洗3次; 用3.7%中性福尔马林固定5 min, PBS洗涤3次; 固定后的细胞用上述油红O稀释液室温孵育1 h后, 蒸馏水漂洗细胞3次, 倒置显微镜下观察并拍照。
各实验独立重复3次以上, 重复性好。所选图表为重复实验的结果之一。数据结果以
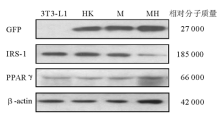
免疫印迹结果见图1。对照组(3T3-L1前脂肪细胞)不表达GFP, 转染HK shRNA质粒、IRS-1 M质粒、IRS-1 MH质粒的3T3-L1前脂肪细胞表达GFP; 与空白对照和转染HK shRNA质粒的细胞比较, 转染IRS-1 MH质粒的3T3-L1前脂肪细胞IRS-1蛋白水平显著下降, 转染IRS-1 M质粒的3T3-L1前脂肪细胞IRS-1蛋白水平无变化。说明针对IRS-1基因设计的shRNA(MH)能够有效抑制3T3-L1前脂肪细胞IRS-1基因的表达。空白对照组(3T3-L1前脂肪细胞)、转染HK shRNA质粒、IRS-1 M质粒和IRS-1 MH质粒的3T3-L1前脂肪细胞PPARγ 的表达无变化。
用经典的鸡尾酒和胰岛素分别诱导转染HK、IRS-1 M质粒和IRS-1 MH质粒的3T3-L1前脂肪细胞分化, 在第8天时进行油红O染色。结果显示转染IRS-1 MH质粒的3T3-L1前脂肪细胞的桔红色脂滴形成减少80%以上, 见图2。
3T3-L1前脂肪细胞系是一种从Swiss3T3小鼠胚胎中分离克隆获得的、具有分化潜力的细胞系。在融合成单层的情况下, 具有自发分化为成熟脂肪细胞的能力。由于该细胞系不但在体外受诱导后可分化为成熟的脂肪细胞, 而且植入小鼠体内后也可分化并形成与正常脂肪组织无明显差别的脂肪团块, 能够较好模拟脂肪细胞分化和活体脂肪组织的功能, 因此目前已成为研究体外脂肪细胞分化的细胞模型[6]。
IRS分子是胰岛素信号的关键调节分子, 在维持细胞的生长、分化及代谢中起核心作用, 由于他们能在含Src同源性2结构域(Src homology 2 domain, SH2)结构域的多种细胞内信号分子与胰岛素受体间起船坞蛋白的作用, 因而IRS分子可能是多种细胞因子表达的调节分子, 在复杂的信号网络调节中居于较上游的位置[7]。目前, 在人类共发现有4个不同的IRS家族成员, 分别为IRS-1、2、3、4[8]。其中IRS-3主要在脂肪代谢中起作用, 其他成员可在多种组织广泛表达, 且其功能也随表达组织的不同而异。IRS-1、2、3在脂肪组织中均有表达, IRS-4在脂肪组织的表达低。Laustsen等[5]通过基因敲除小鼠模型研究发现:IRS-1-/- IRS-3-/-双敲除小鼠分别与野生型、IRS-1-/-、IRS-3-/-比较, 其附睾周围的白色脂肪垫的质量分别减少95%、80%、85%; 整体三酰甘油(TG)的含量减少75%、45%、70%; 组织学分析显示, 脂肪细胞直径减小; Northern blot分析显示, 脂肪细胞分化的标志基因PPARγ mRNA的表达降低。这些体内实验说明IRS-1和IRS-3在促进白色脂肪组织的形成中起了重要作用。体外实验也证实, IRS-1在促进小鼠胚胎前体脂肪细胞的分化中比IRS-2的作用更突出, 但二者都促进脂肪细胞的分化[6]。
PPARγ 是脂肪代谢中一种重要的调节脂肪细胞特定基因表达和诱导前脂肪细胞分化的转录因子[2]。没有PPARγ 时, 前脂肪细胞难以分化为脂肪细胞。在成脂作用和脂肪细胞分化中PPARγ 起着关键性调节作用[9]。
RNA干扰是同源性双链RNA诱发序列特异的转录后基因沉默现象[10], 其可以通过抑制蛋白表达模拟基因敲除技术。RNA干扰具有高特异性、高效、持久的特点, 目前已广泛应用于基因功能的研究。本研究结果显示, 只有针对高度保守的人鼠同源的shRNA(MH)序列才能有效阻断IRS-1的表达。本研究结果说明, 在人和鼠中均高度保守的基因序列是有效的设计shRNA的靶点, 才能干扰3T3-L1前脂肪细胞中IRS-1的表达, M组的RNA干扰是无效的。本研究发现, IRS-1基因沉默后(即MH组), PPARγ 蛋白质的表达与空白对照、转染阴性对照(HK)、IRS-1 shRNA M的3T3-L1前脂肪细胞比较无改变。当用经典的鸡尾酒和胰岛素诱导各组3T3-L1前脂肪细胞分化成熟, 结果发现IRS-1基因沉默组(MH组)PPARγ 蛋白质的表达在整个培养过程中无变化, 而其他组PPARγ 蛋白质的表达随着诱导后培养时间的延长而逐渐增加。培养的第8天, 对各组细胞进行油红O染色可见IRS-1基因沉默组(MH组)桔红色脂滴形成减少。本研究结果说明IRS-1基因的沉默并不改变基础状态下3T3-L1前脂肪细胞PPARγ 的表达, 但却能阻止诱导分化状态下PPARγ 蛋白的表达增加, 前脂肪细胞也不能向成熟脂肪细胞转化。PPARγ 并非以前所认为的是前脂肪细胞向成熟脂肪细胞分化发育的充分条件, 至少在IRS-1表达受阻的情况下, 即使基础状态下PPARγ 表达正常, 也不能诱导IRS-1表达异常的细胞向成熟脂肪细胞分化并分泌出脂滴。所以, 本研究认为IRS-1和PPARγ 两者均正常表达才有可能是前体脂肪细胞向成熟脂肪细胞分化发育的充分必要条件。IRS-1通过调节PPARγ 的表达或与PPARγ 共同作用在3T3-L1前脂肪细胞的分化中发挥决定性作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|