作者简介:方水晶,男,1977年生,学士,主管技师,主要从事分子生物学研究。
探讨第10号染色体上缺失的与张力蛋白同源的基因(PTEN)对乳腺癌细胞生物性状的影响及其潜在机制。
方法利用脂质体介导法将pBP-wt-PTEN、pBP-G129R-PTEN和pBP-G129E-PTEN质粒分别转染入PTEN基因缺失的乳腺癌细胞株ZR-75-1。通过侵袭实验比较 pBP-wt-PTEN、pBP-G129R-PTEN 和 pBP-G129E质粒成功转染细胞和未经转染细胞之间的侵袭能力差异。免疫印迹试验(Western-blot)检测各组细胞的总酪氨酸激酶(FAK)和P397-FAK磷酸化水平;逆转录-聚合酶链反应(RT-PCR)检测各组细胞p53 mRNA 水平,流式细胞术分析其凋亡率。
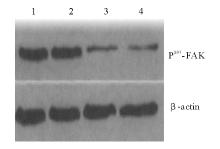
结果pBP-wt-PTEN、pBP-G129R-PTEN 和 pBP-G129E-PTEN 3种质粒转染侵袭抑制率分别为70.4%、6.9%和63.5%; pBP-wt-PTEN细胞P397-FAK水平比pBP-G129R-PTEN细胞低而与pBP-G129E-PTEN细胞差异无统计学意义(
PTEN基因对乳腺癌转移和凋亡有一定的影响。
To explore the influence and underlying mechanism of phosphatase and tensin homology deleted chromosome 10 (PTEN) on the biological character of breast cancer.
MethodsThe plasmids pBP-wt-PTEN, pBP-G129R-PTEN and pBP-G129E- PTEN were transfected respectively into breast cancer cell line ZR-75-1 which lacked gene PTEN by liposomes. The abilities of invasion and migration between transfected cells and nontransfected cells were compared by invasion assay among the plasmids. The phosphorylation levels of tyrosine kinase (FAK) and P397-FAK by Western-blot, the level of p53 mRNA by reverse transcription-polymerase chain reaction (RT-PCR),and the apoptotic ratio by flow cytometry were analysed.
ResultsThe inhibition rates of the invasions of pBP-wt-PTEN, pBP-G129R-PTEN and pBP-G129E-PTEN were 70.4%, 6.9% and 63.5% respectively. The level of P397-FAK of pBP-wt-PTEN cell was lower than that of pBP-G129R-PTEN cell and there was no statistical significance with pBP-G129E-PTEN cell (
There is an influence of PTEN on the migration and apoptosis of breast cancer.
第10号染色体上缺失的与张力蛋白同源的基因(phosphatase and tensin homology deleted on chromosome 10, PTEN)是继发现p53后又一个与多种肿瘤发生、发展密切相关的抑癌基因,而且也是发现的第一个具有双重特异磷酸酶活性的抑癌基因,是最近研究较热的基因之一。许多文献报道,PTEN基因阻碍细胞G1期向S期过渡,抑制细胞增殖,同时可以从多条信号途径促进细胞凋亡。国外学者已经在前列腺癌、膀胱癌的研究中发现PTEN基因可以在一定程度上抑制肿瘤细胞的迁移,但其作用机制尚未明了。本研究旨在探讨PTEN基因对乳腺癌细胞黏附、侵袭能力的影响及其机制,以期PTEN基因能成为乳腺癌转归、预后评价的有用指标,为临床诊断和治疗提供理论依据。
细胞株购自中国医学科学院基础医学研究所;质粒由美国加州大学Furnari教授惠赠;酪氨酸激酶(FAK)和P397-FAK单克隆抗体、山羊抗人Actin多克隆抗体购自Santa Cruz公司;p53和β-actin引物由上海生工公司合成;EPICS-XL流式细胞仪购自Beckman公司;凋亡试剂盒购自Biovision公司。
1. 转染与侵袭试验 将对数生长期ZR-75-1细胞以2×105个/皿接种于3个35 mm培养皿中,用含有15%胎牛血清,但不含抗菌药物的1640培养基,于37 ℃、5% CO2的培养箱中培养24 h。当细胞生长融合率达80%~90%时按LipofectamineTM 2000试剂说明书进行质粒转染。将转染后2 d、生长良好且经过筛选的细胞用胰酶消化,磷酸盐缓冲液(PBS)洗涤3次并计数。用RPMI1640配成1×106/mL细胞悬液。将细胞悬液加到渗透杯(transwell)小室中,每小室100 μL,每组设4个平行小室;将小室浸于24孔板的条件培养基中,5% CO2、37 ℃温育24 h。取出transwell小室,滤膜用甲醇∶丙酮(1∶1)固定10 min后,用棉签小心擦去未侵袭滤膜表面细胞,苏木素(HE)染色,用中性树脂封片。在200倍光学显微镜下随机选择5个视野,计数每个视野细胞数目,取均值,以侵袭细胞的相对数表示细胞的侵袭力,按以下公式计算侵袭抑制率:抑制率(%)=[1-(转染组细胞数均值/未转染组细胞数均值)]×100%。
2. 免疫印迹试验(Western-blot)分析转染和未转染细胞FAK和P397-FAK表达水平 超声波破碎法分别提取各组细胞蛋白质,并测定其浓度。分别稀释各组提取蛋白质至一定浓度,取10 μL进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后进行转膜。取出转移好的醋酸纤维素(NC)膜,判断转移成功后,将膜转移至可加热封接的塑料袋中,加封闭液过夜。按0.1 mL/cm2的量加入适量的已稀释好的第一抗(小鼠抗人FAK或P397-FAK单克隆抗体、山羊抗人Actin多克隆抗体)。室温反应4 h,用吐温20-PBS(TBS)洗涤3次,将膜转入另一塑料袋,加入已稀释好的相应第二抗,平缓摇动1 h,取出NC膜洗涤5次。于暗室中,以化学发光(ECL)试剂显影,图像经扫描仪扫描后,用scion Image图像分析软件进行吸光度积分值分析。
3. 逆转录-聚合酶链反应(RT-PCR)分析p53 mRNA 提取并纯化各组2.0×103个转染细胞的mRNA。RT-PCR引物序列:p53 S,5'-TCTGTG-ACTTGCACGTACTC-3',AS,5'-CACGGATCTGAA-GGGTGAAA-3';β-actin S,5'-ATCATGTTGAGACC-TTCAACA-3',AS,5'-CATCTCTTGCTCGAAGTCCA-3'。按QIAGEN公司的一步法RT-PCR试剂盒说明书操作。琼脂糖凝胶电泳,置凝胶成像系统上观察结果,经扫描仪扫描后,用图像分析软件BandScan4.3进行吸光度积分值分析,计算出p53 mRNA与内参照β-actin mRNA的吸光度积分值之比作为p53 mRNA的相对含量值。每组扫描3次,取平均值。
4. 流式细胞术分析凋亡率 取1支试管,加入100 μL细胞悬液,再加入荧光染色液(Annexin V-FITC)及碘化丙啶染色液(PI)染料各5 μL,混匀,室温避光约5 min。加入缓冲液0.5 mL,混匀,上流式细胞仪检测。凋亡率取对数作正态转换,结果以
ZR-75-1组和G129R组侵袭细胞数明显高于wt组和G129E组( P均<0.05),wt组与G129E组之间及G129R组与ZR-75-1组之间差异无统计学意义( P>0.05)。见 表1。
| 表1 细胞侵袭能力与侵袭抑制率比较(15例) |
PTEN对凋亡的影响:wt、G129E、G129R、ZR-75-1分别为11.3±2.7、6.6±1.7、1.8±1.0、1.3±1.1。wt-PTEN质粒转染细胞凋亡率最高( P<0.05),G129E组高于G129R和未转染组( P<0.05),G129R和未转染组两者之间凋亡率差异无统计学意义( P>0.05)。
癌基因和抑癌基因是调控细胞生长、增殖与分化的重要因素。癌基因突变、扩增、过度表达和抑癌基因突变、失活被认为是肿瘤发生、发展的因素之一。如何找到在某种肿瘤进展中起关键作用的癌基因或抑癌基因是进行基因诊断和治疗的先决条件。
PTEN基因是发现的第1个具有双重特异磷酸酶活性的与多种肿瘤进展相关的抑癌基因,也是最近研究较热的基因之一[ 1],但其具体机制尚未完全弄清楚。我们成功地将3种不同的质粒,分别转染PTEN缺失的ZR-75-1细胞。通过嘌呤霉素筛选、PCR及Western blot证实,我们得到3种表达不同生物活性PTEN产物的ZR-75-1细胞。pBP-wt-PTEN质粒转染细胞表达的PTEN蛋白既有蛋白磷酸酶活性又有脂质磷酸酶活性,pBP-G129R-PTEN质粒转染细胞表达的PTEN蛋白既没有蛋白磷酸酶活性又没脂质磷酸酶活性,而pBP-G129E-PTEN质粒表达产物只有蛋白磷酸酶活性[ 2]。结果发现,转染细胞之间与未转染细胞之间侵袭能力和凋亡率有所差异,并且某些重要的活性蛋白质表达也不同,这表明PTEN基因影响细胞增殖、凋亡信号转导与迁徙的生物性状相关,其影响依赖其表达产物蛋白磷酸酶和脂质磷酸酶活性。
我们分析几种不同的PTEN质粒成功转染的乳腺癌细胞ZR-75-1基因p53转录水平,发现PTEN野生型质粒和G129E转染细胞p53转录水平差异不是很明显,而与G129R和未经转染细胞p53转录水平差异是肯定的。所以我们可以初步认为PTEN蛋白磷酸酶活性对p53转录有影响。p53基因是第2个被鉴定的抑癌基因,其突变是人类恶性肿瘤最常见的基因改变,被认为是肿瘤发生的诱发因素。p53基因作为对DNA损伤作出应答反应的“看家基因”,一方面可以调节、激活参与基因修复的基因群,另一方面可以利用自身的外切酶的活性直接参与基因修复。p53基因激活表达产生的p53蛋白可以使肿瘤细胞“深度冬眠”,或启动肿瘤细胞的程序性死亡。p53肿瘤抑制基因参与调节细胞周期和细胞凋亡在防止细胞癌变过程中有十分重要的作用:(1)调节p21、mdm2、GADD45等下游基因;(2)调节与凋亡有关的基因,如Bax、DR5、IGFs和干扰生长因子的信号转导通路[ 3, 4]。在我们之前,Su等[ 5]发现,PTEN和磷酸肌醇3激酶(PI3K)抑制剂(LY2944002)能诱导恶性胶质母细胞瘤细胞p53转录活性,增加p53和p21的表达。徐瑞等[ 6]利用免疫组织化学技术检测47例经术后证实为癌细胞的组织、42例癌旁组织及10例健康肝组织中PTEN和p53的表达,利用细胞凋亡检测法(TUNEL)检测细胞凋亡水平。结果证实PTEN的表达与p53表达有相关性,与肝癌细胞增殖指数和凋亡指数无相关性,这与我们的结论基本相符。PTEN通过上调p53表达,激活凋亡信号通路和干扰细胞增殖,是发挥抗肿瘤的关键一步。
在我们之前有研究表明,细胞迁移能力与FAK酪氨酸磷酸化水平密切相关,FAK分子Tyr397磷酸化及其激酶活性是整联蛋白引起细胞迁移过程中必不可少的事件。当细胞与细胞外基质(ECM)结合,细胞膜上的整联蛋白聚集成簇,将细胞骨架与ECM连接形成黏着斑,胞质中FAK转位到黏着斑,Tyr397发生自身磷酸化。FAK以p-Tyr397与Src的结合引起FAK分子其他酪氨酸磷酸化,进而结合并活化PI3K,后者激活Racl,介导细胞边缘波动。另外,PI3K还可以增强整联蛋白与配体的亲和力,进一步增强细胞的迁移能力,因此FAK活性在一定程度上决定细胞的迁移能力[ 7]。我们将wt、G129E、G129R 3种表达活性不同的质粒转染ZR-75-1细胞,检测他们FAK和P397-FAK水平,发现四者之间总FAK水平无明显差异,而他们之间P397-FAK水平存在差异,wt细胞和G129E细胞相近,而比G129R和未转染的ZR-75-1细胞低。此研究表明,PTEN的蛋白磷酸酶活性与FAK的397位点酪氨酸残基去磷酸化有关,可能是PTEN抑制ZR-75-1乳腺癌细胞转移的途径之一。
综上所述,PTEN作为第1个被发现的具有双特异磷酸酶活性的抑癌基因,除了通过作用天然底物3,4,5-三磷酸磷酯脂酰肌醇干扰PI3K信号途经,阻抑细胞生长和促进细胞凋亡外, 还可以依赖其蛋白磷酸酶活性对整合素介导的信号传导产生影响, 如使FAK397位点酪氨酸残基去磷酸化,使得细胞迁移浸润能力下降。另外PTEN还可上调或下调某些活性分子的表达、介入细胞增殖凋亡等信号通道而发挥抑癌作用。Gu等[ 8]认为PTEN可能作用于Ras抑制细胞外调节蛋白激酶(ERK/MAPK)信号通路,同时使核转录因子ETS-2去磷酸化,从而影响某些基因的表达。Lee等[ 9]通过小鼠哮喘模型证实,携带PTEN cDNA的腺病毒感染的小鼠和服用PI3K抑制药的小鼠肺组织中的血管内皮生长因子(VEGF)水平比对照组低。Li等[ 10]实验证明肝素连接生长因子(pleitrophin,Ptn)的表达受PTEN-PI3K-细胞存活和凋亡信息通络(AKT)调节,在PTEN缺失的小鼠胚胎纤维母细胞,Ptn易促进肿瘤的发生。我们相信随着我们对PTEN基因认识的加深,PTEN可以成为以后基因治疗的有用靶点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|