作者简介:李 轶,男,1972年生,硕士,主管技师,主要从事临床微生物检验及细菌耐药机制研究。
通讯作者:冯羡菊,联系电话:0371-66913131。
了解河南地区大肠埃希菌中质粒AmpC酶的流行分布及其基因特征。
方法对380株大肠埃希菌进行AmpC酶表型筛选,对筛选阳性株进行多重聚合酶链反应(PCR)及型特异PCR、克隆、测序;等电聚焦电泳检测细菌β-内酰胺酶等电点;接合实验验证质粒传递性;肠杆菌科基因组内重复一致序列(ERIC-2) PCR检测同源性。
结果380株大肠埃希菌中2.1% (8株)的细菌产AmpC酶,经测序证实均为DHA-1型质粒AmpC酶基因,ERIC-2 PCR结果显示质粒AmpC酶主要以非克隆传播为主。
结论河南地区发现DHA-1型质粒AmpC酶以非克隆传播为主。
To investigate the genotype and distribution of plasmid-mediated AmpC β-lactamases in Escherichia coli in Henan.
Methods380 Escherichia coli were detected by standard disc diffusion method which was used as screen test for AmpC β-lactamase. Multiplex polymerase chain reaction (PCR), type-specific PCR, clone, sequencing, isoelectric focusing analysis, conjugation and enterobacterial repetitive intergenic consensus-2 (ERIC-2) PCR were performed on positive strains to determine the genotype, the isoelectric point, the transitivity of plasmid and the homology of AmpC β-lactamases.
Results8 of 380 Escherichia coli strains (2.1%) were AmpC β-lactamases-positive strains. All of them were blaDHA which were confirmed by sequencing. The results of ERIC-2 PCR analysis indicated that the prevalences of plasmid-mediated AmpC β-lactamase were not due to epidemic strains.
ConclusionsThe clinical isolate of Escherichia coli producing DHA-1 type plasmid-mediated AmpC β-lactamase was found in Henan. The prevalence were not due to epidemic strains.
AmpC酶是革兰阴性杆菌产生的最重要的β -内酰胺酶之一, 从1989年Bauernfeind等[1]报道CMY-1型质粒AmpC酶以来, 新的质粒AmpC酶基因在世界各地不断被发现, 近年来成为了临床微生物关注的热点, 大多数研究集中在流行病学、分子生物学、检测方法和耐药特性与治疗上。为掌握质粒AmpC酶在本地区的流行及基因型情况, 我们对380株临床分离的大肠埃希菌进行了研究。
1. 菌株 收集2006至2007年河南省人民医院及郑州大学第一附属医院临床分离的大肠埃希菌380株, 菌株来自痰、脓、血等标本, 无重复株。产CMY-2质粒AmpC酶的阳性株为ampC基因检测对照株; TEM-12、TEM-10、TEM-28、SHV-1、ACT-1为等电聚焦电泳(IEF)对照株; 大肠埃希菌(ATCC 25922)为质控株。所有菌种均用BD凤凰-100全自动细菌鉴定仪鉴定到种。
2. 主要试剂 药敏纸片均购自Oxiod公司; 培养基均购自郑州安图绿科生物工程有限公司; 质粒DNA提取试剂盒和聚合酶链反应(PCR)扩增试剂盒均为上海鼎安生物科技有限公司产品。
3. 仪器 凤凰-100全自动微生物鉴定药敏系统购自美国BD公司; IEF仪及试剂购自安马西亚公司; Mastercycler 5330型PCR 仪购自德国Eppendorf公司。
1. 表型筛选 凡纸片扩散法头孢西丁(FOX)≤ 18 mm, 即认为是AmpC酶筛选阳性。
2. 多重PCR 根据质粒ampC基因的分群, 设计具有群特异性的6对引物[2]
3. β -内酰胺酶基因扩增及测序 按文献[3~5]进行, 筛选β -内酰胺酶基因的引物序列见表1, 用表2引物扩增后测序。
| 表1 PCR引物序列及扩增片段长度 |
| 表2 全序列扩增及测序引物 |
4. 接合试验 参照文献[6]进行, 以多重PCR中筛选出来的DHA来源菌株作为供体菌, 耐利福平的大肠埃希菌C600为受体菌, 培养至对数期后等量混匀, 接种至含100 μ g/mL利福平、10 μ g/mL头孢噻肟的麦康凯培养基上, 过夜培养, 不利用乳糖的菌落才是接合子, 对所有接合子用多重PCR确认是否含有质粒ampC基因。
5. IEF 按操作说明书进行IEF, 电泳完毕, 用0.5 mg/mL头孢硝噻吩显色。抑制试验:分别用0.5 mg/mL头孢硝噻吩加与不加0.3 mol/L氯唑西林或克拉维酸进行显色。
6. 肠杆菌科因组内重复一致序列(ERIC-2) PCR 用ERIC-2引物进行随机扩增多态性DNA分析。2条带以上的差别被认为是有意义的。
380株大肠埃希菌中, FOX≤ 18 mm 71株, 其中8株在多重PCR中出现了405 bp条带(DHA群), 阳性率为2.1%。8株细菌均对氨苄西林、氨苄西林-舒巴坦、头孢唑啉、头孢噻肟及头孢他啶耐药; 同时均对亚胺培南、美罗培南敏感; 3株耐头孢吡肟、5株敏感; 2株耐头孢哌酮-舒巴坦, 6株敏感。
经PCR扩增、测序和Blast比对, 所检测到的质粒ampC基因均为DHA-1型。
有2株细菌接合实验阳性, 经PCR证实基因blaDHA-1被传递。
8株大肠埃希菌及2株接合子均产生等电点(pI)为7.8的β -内酰胺酶, 该酶受氯唑西林抑制而不受克拉维酸抑制; 8株细菌还同时产生pI 5.4的β -内酰胺酶, 该酶受克拉维酸抑制而不受氯唑西林抑制; 部分菌株还产生pI 8.1左右的β -内酰胺酶。
8株细菌均携带blaDHA-1和blaTEM-1, 其中有3株同时携带blaSHV-12; 3株携带blaCTX-M-14; 1株同时携带blaCTX-M-14和blaSHV-12。
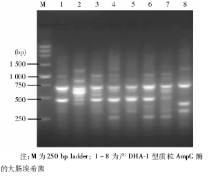
见图1。1、3泳道为同一克隆, 4、6泳道为同一克隆, 其他泳道各不相同, 其中4、6泳道菌株来自同一科室, 而1、3泳道菌株来自不同科室, 显示产质粒AmpC酶的大肠埃希菌以非克隆传播为主。
质粒AmpC酶主要在大肠埃希菌、肺炎克雷伯菌等肠杆菌科细菌中产生, 我国及亚洲地区质粒AmpC酶的流行主要以DHA-1型为主, 也有报道ACT-1和CMY-2, 本研究中发现的质粒AmpC酶均为DHA-1型, 再次证实了这一流行情况。本研究中, 质粒AmpC酶的发生率只有2.1%, 且以非克隆传播为主, 和国内其他研究情况类似。质粒AmpC酶和超广谱β -内酰胺酶(ESBLs)同样是质粒介导的β -内酰胺酶, 同时发现于上世纪80
年代, 到目前ESBLs的发生率已经> 30%, 而质粒AmpC酶的发生率一直保持在10%以下, 其传播以非克隆为主, 未出现类似于ESBLs一样的耐药基因在不同DNA之间的频繁转移。为什么2种质粒介导β -内酰胺酶基因的传递有如此大的区别?除了整合子的解释外, 其他原因值得我们关注, 继续深入的研究将帮助我们控制耐药性的广泛传播。
质粒AmpC酶常和ESBLs等其他β -内酰胺酶同时产生, 增加了临床用药的难度, 如果质粒AmpC酶获得类似于ESBLs的传递方式, 将使临床可用药物的选择进行性减少。因为细菌对FOX耐药有多种机制, FOX纸片法只能作为初步筛选使用, 而三维试验或乙二胺四乙酸(EDTA)法等表型试验均不能区分染色体AmpC酶和质粒AmpC酶, 所以建立一种简便的检测方法及时检测出质粒AmpC酶, 以便及时采取有效措施预防耐药性的产生、传播, 并指导临床用药, 是临床微生物工作者不得不面临的一个难题。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|