作者简介:李薇薇,女, 1977年生,硕士,主治医师,主要从事乳房整形方面研究。
通讯作者:乔 群,联系电话:010-88068830。
探讨聚丙烯酰胺水凝胶中丙烯酰胺含量的可靠测定方法。
方法采用液质联用色谱(HPLC-MS/MS)和同位素稀释定量技术,以选择反应监测(SRM)方式测定医用聚丙烯酰胺样本及20例聚丙烯酰胺临床样本中的丙烯酰胺含量。以丙烯酰胺标准品为对照,样本经水溶液振荡提取,硅藻土柱净化。色谱条件:MG120 C18色谱柱(5 μm粒径, 150 mm×4.6 mm),柱温均26 ℃;流动相为甲醇:0.1%甲酸=1:9, 流速为0.6 mL/ min; 进样量为10 μL。
结果丙烯酰胺分离良好。峰面积与浓度呈良好的线性关系,线性范围可达3 000 μg/L。加标水平在50 μg/L时,回收率为103.1%,相对标准差(RSD)为6.20%。医用聚丙烯酰胺样本中丙烯酰胺含量为3.9×10-9~3.1×10-8 g/L。20例聚丙烯酰胺临床样本中丙烯酰胺含量为(14.39±6.40)×10-9 g/L。
结论该方法样本处理简单,准确度高,灵敏度高,适合聚丙烯酰胺水凝胶中丙烯酰胺含量的测定。
To establish a method for determination of acrylamide in polyacrylamide hydrogel by high performance liquid chromatography-mass spectroscopy(HPLC-MS/MS).
MethodsThe standard sample was used as control. After adding13C3 labeled acrylamide ,the sample was extracted by water and then cleaned up by ExtrelutTM 20. Column:MG120 C18 (5 μm , 150 mm×4.6 mm). Temperature: 26 ℃. Mobil phase:methanol:0.1%formic acid=1:9. Flow rate: 6 mL/ min. Sample quantity:10 μL. Finally the polyacrylamide hydrogel sample and 20 clinical extract sample were analyzed by HPLC-MS/MS and isotope dilution qua.pngy technique in selected reaction monitoring (SRM)mode.
ResultsAcrylamide was perfectly separated from polyacrylamide hydrogel. The concentration of acrylamide in polyacrylamide hydrogel was in range of 3.9×10-9~3.1×10-8g/L and (14.39±6.40)×10-9g/L in 20 clinical samples. The peak area was favorable linear and the range was up to 3 000 μg/L. The recovery rate was 103.1 % with relative standard deviation (RSD) 6.20%,when the mark level was 50 μg/L.
ConclusionsThe results showed that the method is rapid , accurate ,sensitive , and suitable for the determination of acrylamide in polyacrylamide hydrogel.
聚丙烯酰胺是由丙烯酰胺聚合的高水溶性高分子, 近年来广泛应用于食品、供水、冶炼和医用材料中。自1967年以来聚丙烯酰胺作为软组织填充物逐渐应用在美容整形手术中。俄罗斯和乌克兰目前累计受术者3万例左右, 我国目前累计受术者近30~50万, 绝大多数为隆乳患者。但由于聚丙烯酰胺在聚合过程中往往会残留游离的丙烯酰胺, 假如其浓度超标, 将会对人体造成不同程度的伤害。动物实验和体外细胞实验证实丙烯酰胺可导致遗传物质改变和癌症发生[1]。在临床应用中发现植入前胶体呈透明、粘稠胶状; 植入后取出时胶体为淡黄色, 乳糜样, 粘度降低。因此聚丙烯酰胺水凝胶在植入人体后是否会分解为单体成为人们关注的焦点之一。为了解聚合物进入人体后丙烯酰胺的含量变化, 我们有必要寻求一种准确、简便地测定聚丙烯酰胺中丙烯酰胺的含量, 以对目前频频报道的各类临床并发症作出科学解释。目前用于测定丙烯酰胺含量的方法主要有溴化法、改良溴化法、紫外分光光度法等[2]。但大多存在准确度不高, 易受干扰等缺点。根据文献资料[3, 4], 液质联用色谱法(HPLC-MS/MS)能更准确地监测聚丙烯酰胺水凝胶中丙烯酰胺的含量。
1.液相色谱-质谱/质谱联用仪(HPLC-MS/MS) LTQ型线性离子阱质谱仪(Thermo Finnigan公司), 配备Surveyor高效液相色谱仪(Thermo Finnigan公司)。
2.其他仪器 组织粉碎机, 旋转蒸发仪, 氮气浓缩器, 振荡器, 超纯水装置, 电子分析天平(十万分之一), 电子分析天平(千分之一), 玻璃层析柱 (柱长30 cm, 柱内径1.8 cm), 涡漩混合器。
1.试剂 甲酸(分析纯, 北京试剂品公司)、甲酸(色谱纯, Dikma公司)、甲醇(色谱纯, J& T BAKER公司)、正己烷(分析纯, 北京试剂品公司, 重蒸后使用)、乙酸乙酯(分析纯, 北京试剂品公司, 重蒸后使用)、硫酸铵(分析纯, 北京试剂品公司)、无水硫酸钠(分析纯, 北京试剂品公司)、超纯水、工业氮气(纯度> 99.5%, 浓缩使用)、高纯氦气[纯度> 99.995%, 液质联用色谱(LC-MS)分析用碰撞气]、液氮(LC-MS分析用脱溶剂气)、ExtrelutTM 20硅藻土(德国Merck公司)。
2.聚丙烯酰胺样本 聚丙烯酰胺标准品为奥美定, 由吉林富华医用高分子材料有限公司生产(批号20040105MJ01); 丙烯酰胺标准品由Fluka公司提供(纯度> 99.8%, ); 13C3-丙烯酰胺标准品由美国Cambridge Isotope Laboratories公司提供。聚丙烯酰胺临床样本为整形外科聚丙烯酰胺水凝胶注射隆乳患者手术取出的胶体, 共20例。
色谱柱:MG120 C18柱(5 μ m粒径, 150 mm× 4.6 mm, I.D.SHISEIDO公司); 流动相及洗脱条件:流动相为甲醇:0.1%甲酸(1:9), 恒度洗脱; 流速:0.6 mL/min; 柱温:26 ℃; 进样体积:10 μ L。
离子源:阳离子大气压化学电离源(APCI+); 放电电流:5 μ A; 加热毛细管温度:300 ℃; 鞘气(氮气):30 Arb; 辅助气(氮气):10 Arb; 扫描方式:二级全扫描; 源内诱导解离电压(CID):5 V; Q值(Activiation Q):0.5; 碰撞能量:40%; 丙烯酰胺:母离子 72、子离子55; 13C3丙烯酰胺:母离子 75、子离子58; 定量离子:丙烯酰胺为55, 13C3丙烯酰胺为58。
1.丙烯酰胺标准溶液配制 (1) 储备溶液(1 000 mg/L):十万分之一天平准确称取丙烯酰胺标准品10 mg(精确到0.01 mg)于10 mL棕色容量瓶中, 用甲醇溶解并稀释至刻度, -20℃冰箱保存; (2) 中间溶液(100 mg/L):准确移取储备液1.00 mL置于10 mL棕色容量瓶中, 加甲醇稀释至刻度, -20℃冰箱保存; (3) 使用溶液I(10.0 mg/L):准确移取中间溶液1.00 mL置于10 mL棕色容量瓶中, 加0.1%甲酸溶液稀释至刻度, 现用现配; (4)使用溶液Ⅱ (1.00 mg/L):准确移取使用溶液I 1.00 mL置于10 mL棕色容量瓶中, 加0.1%甲酸溶液稀释至刻度, 现用现配。
2.13C3-丙烯酰胺内标溶液配制 (1) 13C3-丙烯酰胺内标储备溶液I(1 000 mg/L):准确称取13C3-丙烯酰胺标准品10 mg(精确到0.01 mg)于10 mL棕色容量瓶中, 用甲醇溶解并稀释至刻度, -20℃保存; (2) 内标储备溶液Ⅱ (10 mg/L):准确移取内标储备液I 1.00 mL, 置于100 mL容量瓶中, 甲醇稀释至刻度, -20℃冰箱保存; (3) 内标使用液(1.0 mg/L):准确移取内标储备液Ⅱ 1.00 mL, 置于100 mL容量瓶中, 甲醇稀释至刻度, -20℃冰箱保存。
称取样本2.00 g (精确到0.01 g), 加入10 mg/L 13C3-丙烯酰胺内标10 μ L, 加超纯水10 mL, 振荡30 min, 于4 000 r/min离心10 min, 取上清液。
取上清液加入硫酸铵固体8 g, 振荡10 min, 使充分溶解, 于4 000 r/min离心10 min, 取上清液10 g, 备用。取洁净玻璃层析柱, 在底部填少许玻璃棉, 压紧, 依次填装无水硫酸钠10 g、ExtrelutTM 20硅藻土2 g。称取5 g ExtrelutTM 20硅藻土, 与上述备用的样本上清液搅拌均匀后装入层析柱中。用正己烷60 mL淋洗, 控制流速2 mL/min, 弃去正己烷淋洗液。用60 mL乙酸乙酯洗脱丙烯酰胺, 控制流速2 mL/min, 收集乙酸乙酯洗脱溶液, 并在45 ℃水浴下减压旋转蒸发至近干, 用乙酸乙酯洗涤蒸发3次(每次1 mL), 将旋转蒸发的样本液转移至已加入1 mL 0.1%甲酸的试管中, 涡旋振荡。在氮气流下吹去上层有机相后加入1 mL正己烷涡旋振荡, 于3 500 r/min离心5 min, 取下层水相过0.22 μ m水系滤膜进行HPLC-MS/MS分析。
将样本和系列标准注入HPLC-MS/MS系统, 记录丙烯酰胺和内标的峰面积。计算丙烯酰胺[质量数(m/z) 55]和13C3-丙烯酰胺内标(m/z 58)的峰面积比, 以各系列标准溶液的进样量(ng)与对应的丙烯酰胺(m/z 55)和13C3-丙烯酰胺内标(m/z 58)的峰面积比绘制线性曲线。
按下式用内标法计算样本中丙烯酰胺的含量(Cn, μ g/kg):
Cn=
式中: ms为样本中加入内标的量(ng); An为目标化合物的峰面积; As为定量内标的峰面积; m为取样量(g)。
按下式计算RRF:
RRF=
式中:An为目标化合物的峰面积; Cn为目标化合物的含量(ng/mL); As为内标的峰面积; Cs为内标的含量(ng/mL)。
以标准系列溶液进样, 记录丙烯酰胺和13C3-丙烯酰胺内标的峰面积, 以丙烯酰胺和13C3-丙烯酰胺内标的峰面积比和对应的标准溶液中丙烯酰胺的质量进行线性回归计算。
以回收率衡量方法的准确度, 以相对标准偏差(RSD)作为方法的精密度, 回收率是加标样本与同浓度的标准品的响应信号(即峰面积)的比值, RSD= 标准偏差/平均值× 100 %。
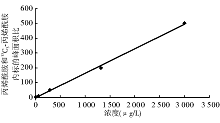
线性方程为Y =165.22X-2.254 7, 相关系数(R2)= 0.998 3。在3 000 μ g/L以内, 线性相关性良好, 而且该范围基本覆盖了医用聚丙烯酰胺中丙烯酰胺的含量, 见图1。
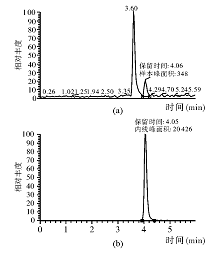
采用上述试样的提取、净化方法处理医用聚丙烯酰胺样本, 用HPLC-MS/MS 测定的色谱图见图2。丙烯酰胺保留时间前有干扰峰, 但分界明显, 目标化合物的色谱峰峰型对称、尖锐。样本丙烯酰胺含量为3.9× 10-9~3.1× 10-8g/L, 结果低于ISO 质量标准及国家医疗器械生物评价标准[5]。20例聚丙烯酰胺临床样本中丙烯酰胺含量为(14.39± 6.40)× 10-9g/L。
早期的丙烯酰胺检测方法多使用液-液萃取分离待测物质, 如气相色谱(GC)/高灵敏度恒流电子捕获检测器(ECD)、高灵敏度氢焰离子化检测器(FID)或氮磷检测器(NPD)、气质联用色谱(GC/MS)测定。这些方法为寻求更加简便、灵敏和可靠的检测方法提供了参考和指导。但是这些方法较高的检测限制了低含量丙烯酰胺样本的测定, 且方法操作费时、繁琐, 故其应用较为局限[6] 。随后出现的检测方法多是将样本用固相萃取法(SPE) 处理后用GC、高效液相色谱(HPLC)或各种联用技术直接测定丙烯酰胺含量。相比早期的检测方法, 操作更简便、省时, 方法的精密度和灵敏度更高, 应用范围更宽, 但是由于固相萃取设备和各种联用技术的引入, 相应的分析成本提高, 从而给方法的普及应用增加了难度。
HPLC引入了气相色谱理论, 在技术上采用高压泵、高效固定相和高灵敏度检测器, 实现了分离速度快、效率高和操作自动化。几乎所有的化合物包括高极性/离子型待测物和大分子物质均可用HPLC 进行测定。刘苗苗等[7]、亢晓冬等[8]、唐婷等[9]均报道用HPLC测定医用聚丙烯酰胺水凝胶中丙烯酰胺。但该法均用外标法检测。虽然此法操作简便、重现性好, 精密度和检测限符合痕量分析要求, 但和HPLC-MS采用内标法相比, 精确度还是有一定差距。
LC-MS、LC-MS/MS[10]一种集高效分离和多组分定性、定量于一体的系统。采用内标法, 既发挥了液相色谱对化合物的分离能力, 又体现了质谱特异性、灵敏度, 提供了组分分子量及结构信息。LC-MS 可以直接分析水溶液样本, 对分析者的危害性相对较小, 而且样本处理相对较容易。2002年6月世界卫生组织(WHO)和联合国农业及粮食组织(FAO)认同GC-MS和LC-MS/MS 2种方法, 认为这2种方法的结果有良好的相似性。美国食品药物管理局(FDA) 2003年2月公布了食品中丙烯酰胺的检测方法草案[11]。因此我们认为HPLC-MS/MS在检测聚丙烯酰胺水凝胶中丙烯酰胺含量方面更有说服力。另外, 所有体内取材样本检测时均发现丙烯酰胺峰前方均出现干扰峰, 但分界明显, 且含量小, 聚丙烯酰胺标准品检测时无此干扰峰, 有无可能是血液污染, 或聚合物在体内产生其他变化, 有待进一步研究。
由于目前对人血清样本的前处理仍然没有很好的方法, 无法排除血液成分的干扰, 本法暂时还无法进行血清样本的检测。因此, 目前对于体内植入聚丙烯酰胺的患者, 我们只有采取手术取样的方法来检测丙烯酰胺。在自然条件下, 聚丙烯酰胺会发生缓慢的物理降解(热、剪切)、化学降解(水解、氧化以及催化氧化)和生物降解, 最终生成各种低聚物以及具有神经毒性的剧毒丙烯酰胺, 对人体造成了极大的间接或直接危害, 而聚丙烯酰胺植入人体后是否分解, 是否被吸收仍未可知。但是一旦有分解, 对人体的伤害是必然的。WHO饮用水中丙烯酰胺的含量限定为1 μ g/L[12]。依据高萍等[5]的研究, 丙烯酰胺浓度< 1.00× 10-8 g/mL , 无毒性; 丙烯酰胺浓度在1.00× 10-7~2.50× 10-4 g/mL之间细胞毒性为Ⅰ 级, 即轻微毒性。本研究共检测了20例聚丙烯酰胺临床样本, 样本中丙烯酰胺含量为(14.39± 6.40)× 10-9 g/L。因此本研究丙烯酰胺浓度仍属安全范围。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|