作者简介:李永军,男,1967年生,硕士,副主任技师,主要从事免疫学检验工作。
研究白藜芦醇诱导人食管癌Eca109细胞凋亡的作用并探讨其对凋亡相关基因survivin、bax 和bcl-2表达的影响。
方法不同浓度白藜芦醇作用于Eca109 细胞后,采用流式细胞仪检测细胞凋亡、细胞周期分布及survivin、bax 和bcl-2蛋白的表达。
结果白藜芦醇能诱导食管癌Eca109细胞凋亡,使其细胞周期阻滞在G0/G1期;白藜芦醇可以上调bax蛋白的表达,下调survivin蛋白并协同抑制bcl-2 蛋白的表达。
结论白藜芦醇能明显诱导Eca109细胞凋亡,其机制可能与促进bax表达、抑制survivin和bcl-2表达有关。
To investigate the effects of resveratrol on apoptosis and expression of survivin, bax and bcl-2 in human Eca109.
MethodsEca109 cells were treated with different concentrations of resveratrol. Flow cytometry was used to analysis the apoptosis and cell cycles,as well as the expression of survivin,bax and bcl-2 proteins.
ResultsResveratrol could induce the apoptosis of Eca109 cells and block their cell cycles on G0/G1.Resveratrol could up-regulate bax protein, while down-regulate survivin and bcl-2 proteins.
ConclusionsResveratrol can induce apoptosis of human esophageal cancer Eca109 cells, which might be related to modulate the expression of survivin,bax and bcl-2.
白藜芦醇(resveratrol)属非黄酮多酚类物质, 是葡萄属植物产生的一种植物抗毒素, 主要含在葡萄、花生及中草药虎杖等植物中。白藜芦醇具有多种生物活性, 包括抗氧化活性、抗炎、雌激素样活性、生长抑制活性、免疫调节、化学预防[1~3]以及抗肿瘤作用。白藜芦醇对肺癌、前列腺癌、胰腺癌、肝癌、乳腺癌、白血病等均具有拮抗作用[4~8]。但目前, 国内外少有白藜芦醇用于食管癌防治的可行性报道[9]。因此, 我们采用流式细胞技术检测白藜芦醇诱导食管癌Eca109细胞凋亡的作用并测定食管癌Eca109细胞凋亡相关基因survivin、bax 和bcl-2的表达, 进一步探讨白藜芦醇的作用机制。
白藜芦醇, 纯度> 99.5%, 为美国Sigma公司产品; RPMI1640培养基购自美国Promega公司; 鼠抗人survivin、bax、bcl-2蛋白单克隆抗体, 异硫氰酸荧光素(FITC)标记的羊抗鼠二抗购自美国Santa Cruz公司。
CO2培养箱(Heraeus BB6220, 德国); ACS420 型流式细胞仪 (光源为 2 W氩离子激光器, 工作效率为 300 mW, 激发波长为 488 nm, 为美国BD公司产品)。
1. 细胞培养 Eca109细胞株由河北医科大学第四医院科研中心保存。培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI1640培养基中, 置37 ℃、饱和湿度5% CO2的培养箱中培养, 3 d传代1次, 取对数生长期细胞用于实验。
2. 流式细胞仪检测细胞凋亡和细胞周期 平行接种Eca109细胞于3个大细胞培养瓶内, 待细胞铺满瓶底60%的密度时, 进行细胞换液, 换为不含胎牛血清的新鲜培养液, 继续培养24 h(目的是使细胞同步化)后, 再次给细胞换液, 换为含10%胎牛血清的新鲜培养液, 同时加入白藜芦醇, 使其终浓度分别为0、20和40 μ g /mL。经白藜芦醇作用72 h后, 用0.5%的胰蛋白酶消化, 调整细胞浓度约1× 106/mL。分别收集细胞于离心管内1 000 r/min离心5 min后, 弃上清; 冷磷酸缓冲液漂洗2次, 1 500 r/min离心5 min; 70%预冷的乙醇分散细胞, 4 ℃固定过夜; 离心固定后的细胞, 1 500 r/min离心10 min, 用磷酸缓冲液快速洗涤细胞, 去除乙醇固定液; 然后生理盐水洗涤2次, 1500 r/min离心5 min后, 加入碘化丙锭(PI)染液(PI:50 mg/L, Triton X-100:1.0%, 核糖核酸酶 A:10 mg/L), 4 ℃避光染色30 min, 过滤; 在流式细胞仪上, 以 10%鸡血红细胞作为内参标准, 与标本同步染色, 用 488 nm 激发光检测细胞 DNA 含量并输入 MuticycleAV 软件进行分析, 计算细胞凋亡率。
3.透射电子显微镜观察细胞凋亡情况 当细胞生长到70%融合时, 加入终浓度为40 μ g/mL含白藜芦醇的培养基, 培养72 h后, 收集细胞, 然后用体积分数为2.5%戊二醛(0.1 mol/L磷酸缓冲液, pH值7.4)固定; 用10 g/L锇酸后固定; 丙酮系列脱水; 最后用Epon821环氧树脂包埋; KB-1型超薄切片机切片; 醋酸铀与柠檬酸铅双重染色; 在电镜下观察。
4. 流式细胞仪测定survivin、bax 和bcl-2蛋白的表达 分别收集细胞浓度约 1× 106/mL经 0、20和40 μ g/mL白藜芦醇培养72 h后的细胞(同方法2); 用磷酸缓冲液洗2次, 1 500 r/min 分别离心5 min; 70%预冷的乙醇分散细胞, 4 ℃固定过夜; 离心固定后的细胞, 1 500 r/min离心10 min, 用磷酸缓冲液快速洗涤细胞去除乙醇固定液; 生理盐水洗2次, 1 500 r/min 分别离心5 min后, 每个浓度分为3管, 各管分别加入 survivin、bax和bcl-2鼠抗人单克隆抗体 0.1 mL, 置室温30 min, 磷酸缓冲液洗涤1次; 然后再分别加入羊抗鼠FITC-IgG1二抗 0.1 mL, 避光置室温30 min后, 磷酸缓冲液洗涤以除去未结合的多余荧光抗体, 加入磷酸缓冲液 0.1 mL, 经500目铜网过滤后, 在流式细胞仪上用488 nm激发光检测, 一抗分别为鼠抗人survivin、bax、bcl-2蛋白单克隆抗体, 二抗为FITC羊标记抗鼠-IgG, 同时设有一抗和二抗的同型对照和阴性对照。应用 Expo32ADC 软件进行数据分析, 蛋白定量表达以荧光指数(fluorescence Index, FI)表示。公式:FI=标本蛋白表达的平均荧光强度/正常对照标本平均荧光强度。
数据用
流式细胞仪检测结果显示, 经20、40 μ g/mL白藜芦醇处理Eca109细胞72 h后, 可见G0/G1期细胞百分比增多, S期、G2/M期细胞百分比减少, 出现G0/G1期阻滞, 见表1、图1。凋亡率分别为(8.54± 0.52)%和(18.79± 0.73)%, 与对照细胞(0 μ g/mL白藜芦醇培养的Eca109细胞)组(0.23± 0.02)%比较差异具有统计学意义(P< 0.01)。DNA直方图上可以观察到亚二倍体凋亡峰。见图2。
| 表1 不同浓度白藜芦醇作用于Eca109细胞后对细胞周期的影响( |
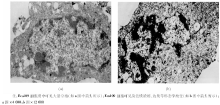
40 μ g/mL的白藜芦醇干预细胞72 h后电镜下观察, 结果显示有细胞凋亡的初步特征:可见核染色质浓缩边集于核膜, 电子密度增加, 部分细胞膜向外层呈锐角突起。胞质内线粒体和部分嵴、部分膜融合或消失, 粗面内质网数量减少有脱颗粒现象, 细胞质内有空泡化变性。见图3。
白藜芦醇处理Eca109细胞72 h后, 流式细胞仪分析结果显示bax蛋白表达升高, 与对照组比较差异具有统计学意义(P< 0.01), survivin、bcl-2蛋白表达下降, 与对照组相比差异有统计学意义(P< 0.01), 见表2。
| 表2 白藜芦醇作用于Eca109细胞72 h后survivin、bax和bcl-2蛋白表达变化( |
Jang等[10]对白藜芦醇在癌症的起始、促进及发展阶段表现出的抑制作用进行了系列报道, 从而使白藜芦醇成为癌症化学预防和化学治疗领域的一个研究热点。目前, 关于白藜芦醇抗肿瘤作用的机制至今仍不很清楚。一般认为, 诱导凋亡和生长停滞是白藜芦醇抗肿瘤生长的2个主要机制, 但白藜芦醇作用于不同的肿瘤, 其机制亦不同。
本研究利用凋亡细胞可以摄取核酸染料PI, 而活细胞不能摄取的原理在流式细胞仪检测中对凋亡细胞加以区别。PI为核酸嵌入型染料, 可嵌入双股螺旋多核苷酸结构, 故DNA和RNA均着色。PI不能穿过活细胞膜, 但能穿过死细胞膜, 因此常用PI测定细胞活力。细胞发生凋亡后, 有DNA断裂和丢失, 在流式细胞分析时有特殊信号出现, 表现为G0/G1期(反映非凋亡细胞)前出现一个信号峰, 称为Sub-G1期(亚二倍体凋亡峰), Sub-G1期细胞数量占检测细胞总数的百分比即为细胞发生凋亡的比例。流式细胞仪检测白藜芦醇处理后的Eca109细胞凋亡的结果显示, 白藜芦醇可以提高Eca109细胞凋亡率, 降低增殖指数, 而且随着剂量的增加, 其诱导细胞凋亡的作用增强。但近年来, 有研究发现典型的凋亡形态并不一定伴有核小体间DNA降解及断裂, 且亚二倍体并不一定都是凋亡细胞, 利用PI法检测凋亡可能有很大的错检或漏检[11]。目前多采用PI法和磷酯酰丝氨酸结合蛋白(AV)法相结合的手段来分析细胞凋亡情况。但由于本实验室条件有限, 未能采用两者结合的方法进行分析。因此, 辅以透射电子显微镜从形态学角度观察细胞凋亡的情况, 结果显示, 白藜芦醇处理后的Eca109细胞与对照细胞相比, 出现了包括染色质浓缩、边集, 细胞质空泡样变性, 电子密度增高等细胞凋亡的初步形态学改变。因此, 通过流式细胞仪检测辅以电镜下形态学观察细胞凋亡情况可以证实白藜芦醇能够诱导Eca109细胞发生凋亡, 且诱导肿瘤细胞凋亡可能是白藜芦醇抗肿瘤的主要机制之一。
survivin是一种凋亡抑制蛋白, 广泛表达于人类各种肿瘤, 具有抑制细胞凋亡、参与细胞周期调节和促进血管形成等功能。很多研究已经证实食管癌中survivin 基因高表达。Nemoto等[12]的研究表明, survivin 在食管癌组织中的表达明显高于正常黏膜, 癌组织分化越低survivin表达越高, 而且癌组织中的凋亡细胞比例与survivin的表达呈负相关, 表明survivin 与食管癌的生物学行为及凋亡有关, 所以survivin 有望成为食管癌基因治疗的一个新的有效靶点。在我们的实验中, 通过流式细胞仪检测发现白藜芦醇可以下调survivin的表达, 这可能是白藜芦醇诱导 Eca109细胞凋亡的原因之一。
bax和bcl-2是bcl-2家族中作用相反的一对凋亡相关基因, 二者的比例调节细胞受到刺激后的凋亡发生。现有研究发现, bax和bcl-2不但在前列腺癌、肝癌、乳腺癌等肿瘤的细胞凋亡调控中发挥重要作用[13~15], 而且与食管癌细胞凋亡密切相关。许多药物诱导食管癌细胞凋亡的同时伴有bax表达的升高和bcl-2表达的降低。我们采用流式细胞仪检测了白藜芦醇作用于Eca109细胞后bcl-2和bax的表达情况。结果显示, 随着白藜芦醇剂量的增加bcl-2的表达减少, 而bax的表达升高。因此, 提示白藜芦醇诱导Eca109细胞凋亡可能与上调bax和下调bcl-2 的表达相关。
综上所述, 白藜芦醇可诱导食管癌Eca109细胞凋亡, 使其阻滞在G0/G1期。survivin在细胞凋亡过程中表达上调, 证明survivin可能在白藜芦醇诱导Eca109细胞凋亡过程中起到了重要作用, 而凋亡相关基因bax的下调和bcl-2的上调可能与survivin的表达在白藜芦醇诱导细胞凋亡中起拮抗和协调作用。这将为阐明白藜芦醇诱导食管癌细胞凋亡提供有力的实验依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|