作者简介:张春兵,男,1969年生,博士,副主任技师,主要从事分子免疫学研究。
通讯作者:詹 瑧,联系电话:025-85811925。
分析川芎嗪预处理大鼠肾上腺嗜铬细胞瘤克隆化细胞株PC12细胞后二甲酰胺诱导的细胞凋亡情况,探讨川芎嗪治疗脑缺血再灌注损伤的机制。
方法采用川芎嗪预处理PC12细胞后,制备二甲酰胺细胞损伤模型,通过CCK-8法活细胞检测、Hoechst-33342染色、流式细胞术和实时荧光定量聚合酶链反应(RT-PCR)分析细胞凋亡发生机制。
结果川芎嗪预处理后,PC12细胞的存活数提高,细胞未见大量核固缩及凋亡小体形成,总体凋亡率降低,caspase 3 、caspase 9活性降低,线粒体膜电位提高,Bax/Bcl-2比值降低。
结论川芎嗪预处理后可以降低二甲酰胺诱导的PC12细胞凋亡。
To analyze whether tetramethylpyrazine could protect PC12 cell from apoptosis induced by diamide in order to explore the mechanism of tetramethylpyrazine in the treatment of cerebral ischemia-reperfusion injury.
MethodsAfter PC12 cells were cultured by tetramethylpyrazine, diamide was added to induce the apoptosis of PC 12 cells. Various methods, including CCK-8 live cell test, Hoechst-33342 staining, flow cytometry, and quantitative reverse transcription/polymerase chain reaction (RT-PCR), were used to analyze the mechanisms involved in the process.
ResultsAfter the pre-treatment, tetramethylpyrazine reduced the apoptosis of PC12 cells. The number of PC12 cells increased compared with decreased apoptosis rate. Tetramethylpyrazine could improve the activity of caspase 3, caspase 9 and the electric potential of mitochondrial membrane and the rate of Bax/Bcl-2 droped in the response to tetramethylpyrazine.
ConclusionsThe pre-treatment with tetramethylpyrazine could reduce the apoptosis of PC12 cells damaged by diamide.
脑缺血再灌注损伤是一个复杂的病理生理过程, 抑制再灌注损伤已经成为目前治疗缺血性脑卒中的关键。川芎嗪是从川芎的根茎中提取的有效成分, 化学结构为四甲基吡嗪, 能减轻脑缺血再灌注性脑损伤程度, 具有显著的缺血后脑保护作用[1, 2]。前期研究以及其他实验报道, 川芎嗪可以穿透血脑屏障, 降低缺血再灌注损伤区神经元的凋亡。PC12细胞株来源于大鼠的嗜铬细胞瘤细胞, 广泛应用于脑缺血再灌注损伤机制研究[3]。Pias等[4]研究认为含硫氧化剂二甲酰胺可诱导PC12细胞凋亡。本研究就川芎嗪能否降低二甲酰胺诱导的PC12细胞凋亡及相关机制进行了探讨。
1. 试剂和仪器 PC12细胞(中国科学院细胞库); 盐酸川芎嗪注射液(40 mg/2 mL, 江苏无锡市第七制药厂, 批号011014); 二甲酰胺(以色列Sigma-aldrich公司); 聚合酶链反应(PCR)相关试剂(大连宝生物公司); CCK-8试剂盒和Hoechst-33342染料(日本Dojindo公司); Annexin-V(AV)-FITC和碘化丙啶(propidium iodide, PI)(奥地利Bender Medsystem公司); Active caspase-3 、8、9 Staining Kit(美国Biovision公司); 罗丹明123(美国Invitrogen公司)。CO2恒温细胞培养箱6500(美国NAPCO公司); FACSCalibur 流式细胞仪(美国Becton Dickinson公司); ABI7500实时荧光定量PCR检测系统(美国Applied Biosystems公司)。
1.细胞培养及传代 PC12细胞疏松贴壁生长, 培养于含5%CO2的37 ℃细胞培养箱, 0.25%胰酶消化制备成单细胞悬液, 每孔1× 105个细胞接种到96孔细胞培养板中, 隔天换液, 生长至70%~80%单层。
2.二甲酰胺模型及川芎嗪保护实验 PC12细胞生长成单层后, 预用川芎嗪(0、0.1、1、10 mmol/L)处理PC12细胞, 孵育60 min后, 换入200 μ mol/L的二甲酰胺培养液孵育12 h, 再换入不含二甲酰胺培养液, 复孔培养。分组如下, 0组:0 mmol/L川芎嗪+0 μ mol/L二甲酰胺; 1组:0 mmol/L川芎嗪+200 μ mol/L二甲酰胺; 2组:0.1 mmol/L川芎嗪+200 μ mol/L二甲酰胺; 3组:1 mmol/L川芎嗪+200 μ mol/L二甲酰胺; 4组:10 mmol/L川芎嗪+200 μ mol/L二甲酰胺。
3.CCK-8法检测细胞毒性 培养48 h后, 每孔加入10 μ L的CCK-8溶液, 37 ℃孵育2 h, 酶标仪测定450 nm处的吸光度(A)值。细胞活力=(A加药-A空白)/(A未加药-A空白)× 100%。
4.Hoechst-33342染色 PC12细胞接种至孔内预置玻片的24孔细胞培养板。分别用0和1 mmol/L川芎嗪预处理细胞单层后, 制备二甲酰胺细胞损伤模型。48 h后, 取出含有细胞单层的玻片, 多聚甲醛固定, Hoechst-33342染色并室温避光孵育10 min后荧光显微镜观察, 激发波长为350 nm。
5.流式细胞术检测细胞凋亡 (1) AV-FITC/PI检测:0.25%胰酶消化制成单细胞悬液, PBS缓冲液洗涤, 计数后每离心管中加入105细胞/100 μ L, 先后加入5 μ L AV-FITC、5 μ L PI, 4 ℃避光孵育10 min后进行流式细胞仪检测, 激发光波长488 nm, FITC荧光检测波长为515 nm, PI检测波长> 560 nm; (2) Caspase活性检测:离心管中加入105细胞/100 μ L细胞悬液300 μ L, 加入caspase底物或caspase抑制物1 μ L, 于含5%CO2的37 ℃细胞培养箱中孵育30 min, PBS缓冲液洗涤后立即进行流式细胞检测, 激发波长488 nm, 发射波长530 nm; (3) 线粒体膜电位检测:每孔105细胞/100 μ L接种到96孔细胞培养板中, 加入罗丹明123染液5 μ g/mL, 于含5%CO2的37 ℃细胞培养箱中孵育15 min; 培养基洗细胞2次; 重悬细胞于培养基中, 孵育60 min; 流式细胞仪检测, 激发波长488 nm, 发射波长530 nm。
6.实时荧光定量PCR检测Bax和Bcl-2 具体操作程序按参考文献[5]。以GAPDH为内参, 引物及探针序列见表1, PCR循环条件均为94 ℃预变性2 min; 94 ℃变性30 s, 54 ℃退火延伸45 s, 扩增40个循环; 延伸步骤中采集荧光信号。以PMD18-T为载体制作Bcl-2、Bax、GAPDH标准品。
| 表1 引物及探针序列 |
数据以
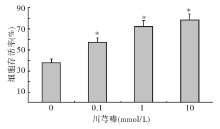
200 μ mol/L二甲酰胺处理PC12细胞后, 活细胞数量降低。应用不同浓度的川芎嗪预处理后, 可以剂量依赖性的提高PC12细胞存活率, 降低二甲酰胺神经细胞毒性(P< 0.05), 见图1。
1.200 μ mol/L二甲酰胺模型中, PC12细胞的细胞核固缩, 凋亡小体形成。1 mmol/L川芎嗪预处理组的细胞核荧光强度均匀一致, 未见大量凋亡小体。
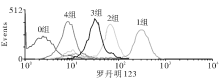
2. 200 μ mol/L二甲酰胺处理PC12细胞, 细胞凋亡(20.17%± 1.19%)显著升高 ; 川芎嗪预处理后, 二甲酰胺诱导的PC12细胞凋亡率显著降低, 并且呈剂量依赖性(P< 0.05), 见图2。0.1 mmol/L组 PC12细胞凋亡率是14.15%± 1.24%, 1 mmol/L组 PC12细胞凋亡率是15.72%± 1.45%, 10 mmol/L组 PC12细胞凋亡率是6.62%± 0.97%。
二甲酰胺模型组可见荧光显著增强, 表明线粒体膜电位下降; 而经过川芎嗪预处理后, 荧光强度减弱, 且亦可观察到剂量依赖性, 表明川芎嗪可以剂量依赖性的提高线粒体膜电位, 抑制PC12细胞凋亡见表2。
| 表2 川芎嗪调控二甲酰胺模型组caspase活性 |
二甲酰胺作用后, caspase-8、caspase-9和caspase-3活化。川芎嗪预处理后, caspase-3和caspase-9活性降低, 且呈剂量依赖性, caspase-8活性未见显著改变。见图3。
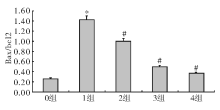
二甲酰胺处理后, Bax/Bcl-2显著升高; 川芎嗪预处理后, Bax/Bcl-2呈现剂量依赖性降低(P< 0.05)。见图4。
脑血管病中, 缺血性脑血管病约占80%, 脑组织缺血将会导致局部脑组织及其功能的损害, 及时地恢复血液再灌注有利于减轻脑缺血损伤, 然而近年来发现, 缺血后血流的恢复在某些情况下能导致进一步的组织损伤和功能障碍[6], 这种恢复血流灌注后的有害情况称为脑缺血再灌注损伤。脑缺血再灌注损伤是一个复杂的病理生理过程, 抑制再灌注损伤已经成为目前治疗缺血性脑卒中的关键。
含硫氧化剂二甲酰胺可以直接氧化谷胱甘肽, 产生氧自由基。Pias等[4]应用含硫氧化剂二甲酰胺诱导PC12细胞凋亡, 观察了其发生的作用机制, 认为二甲酰胺可以通过调控Bax/Bcl-2比率等诱导PC12细胞凋亡。基于这一发现, 本研究设计通过制备二甲酰胺PC12自由基损伤细胞模型, 探讨川芎嗪的缺血后脑保护作用与细胞凋亡的关系。
在能量代谢和自由基代谢中, 线粒体参与一般抗氧化防御及细胞凋亡等重要生理过程的调控[7]。实验结果显示二甲酰胺可以诱导线粒体膜电位下降; 而川芎嗪预处理后可以拮抗二甲酰胺细胞毒性, 可以提高线粒体膜电位; 流式细胞检测到二甲酰胺作用后, caspase-3、8、9皆活化。川芎嗪预处理后, caspase-3、9活性降低, 呈剂量依赖性, 而caspase-8活性未见显著改变。这提示川芎嗪预处理后, 线粒体膜电位升高, 其释放细胞色素c, 与procaspase-9等结合形成apoptosome的复合体, procaspase-9再自我酶解成caspase-9, caspase-9激活caspase-3引发凋亡的内源性途径受到抑制, 而川芎嗪对外源性途径无抑制作用; 二甲酰胺处理PC12后, Bax/Bcl-2显著升高, 与Pias等[4]的研究结果一致; 川芎嗪预处理后, Bax/Bcl-2呈现剂量依赖性降低。提示川芎嗪亦可通过调控Bax/Bcl-2水平抑制二甲酰胺的诱导作用。
本研究结果表明二甲酰胺可以通过破坏线粒体膜电位, 诱导Bax/ Bcl-2表达失去平衡, 活化caspase进而导致PC12细胞凋亡。川芎嗪的预处理则在上述环节降低了二甲酰胺的毒性作用, 提示了川芎嗪的临床应用机理。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|