作者简介:朱 岚,女,1979年生,学士,助理研究员,主要从事临床免疫分析研究。
建立甲状腺过氧化物酶 (TPO) 抗体间接时间分辨荧光免疫分析法(TRFIA)。
方法用TPO抗原包板,用铕(Eu3+)标记兔抗人IgG做标记物,建立检测人血清TPO抗体的间接TRFIA。
结果TPO抗体-TRFIA的敏感性为1.0 IU/mL;线性范围达1 000 IU/mL;批内变异系数( CV)为3.1%~3.6% ,批间 CV为3.3%~3.6% ;平均回收率为98.89%;与电化学发光分析法(ECLIA)比对,相关系数达0.983 2;与临床诊断高度相关。
结论本研究建立的TPO抗体-TRFIA是一个高灵敏和可靠的检测方法,有助于甲状腺疾病的临床诊断。
To explore an indirect time-resolved fluoroimmunoassay(TRFIA)for the detection of thyroid peroxidase(TPO)antibody and its clinical application.
MethodsThe TPO antigen was coated on the 96 well plates. Rabbit anti-human IgG-europium (Eu3+) was used as conjugate. Serum TPO antibody level was determined by the indirect TRFIA.
ResultsThe assay sensitivity was 1.0 IU/mL. The linear range was 1 000 IU/mL. Intrassay coefficient of variation ( CV) was 3.1%-3.6%. Interassay CV was 3.3%-3.6%. The average recovery was 98.89%. Correlation coefficient between TPO antibody-TRFIA and electrochemiluminescence immunoassay (ECLIA) was 0.983 2. The results were highly relevant to clinical diagnosis.
ConclusionsThe indirect TRFIA for TPO antibody detection in serum is a sensitive and reliable assay which is useful to clinical diagnose for thyroid diseases.
甲状腺过氧化物酶 (thyroid peroxidase, TPO) 抗体普遍存在于自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)中, 测定其值对了解人体甲状腺功能具有重要意义, 是毒性弥漫性甲状腺肿(Graves' 病)、桥本氏甲状腺功能亢进症诊断、鉴别诊断及疗效观察的首选指标 [1, 2]。经过探索和研究, 我们建立了TPO抗体间接时间分辨荧光免疫分析法(TRFIA)。
1.研究对象 153例甲状腺疾病患者和32例非甲状腺疾病患者为江苏省江原医院住院和门诊患者; 252名甲状腺功能正常者为健康体检者。
2.试剂和仪器 兔抗人IgG(华美生物工程公司); TPO抗原(Medix公司); 防腐剂(Proclin-300, Supelco公司)、聚氧乙烯山梨糖醇酐单月桂酸酯(Tween 20, Sigma公司); 牛血清白蛋白(BSA, 深圳晶美生物工程有限公司); 铕(Eu3+)标记盒(PE公司); 凝胶过滤(Sepharose CL-6B)柱(Pharmacia公司)。TPO抗体国家标准品(150557-200601, 中国药品生物制品检定所)。96孔微孔板(Nunc公司)。洗脱液、增强液、洗涤液、质控均为本室自配, 其他试剂均为国产分析纯。冻干机(上海东富龙冷冻干燥设备公司)。DELFIA 1235全自动TRFIA检测仪(PE公司), Elecsys电化学发光仪(2010型, 线性范围为5~600 IU/mL)及TPO抗体检测试剂(Roche公司)。
1.TPO抗体标准品的配制 收集临床检测TPO抗体高值血清(乙型肝炎病毒抗原、丙型肝炎病毒抗体、人类免疫缺陷病毒抗体均为阴性), 合并, 加Proclin -300适量。经反复冻融、离心、过滤等处理后得到标准品原液, 用人去激素血清(含0.1%叠氮钠)配制成不同浓度的标准品, 用TPO抗体国家标准品校准各标准点的浓度, 每瓶1 mL分装, 冻干, -20 ℃保存。
2.固相抗原包被板的制备 TPO抗原采用50 mmol/L Na2CO3-NaHCO3缓冲液(pH值9.6)稀释至合适浓度, 每孔200 μ L包被, 振荡30 min, 4 ℃过夜。弃包被液, 每孔加250 μ L含有10% BSA的上述缓冲液封闭2 h, 真空抽干, 密封, 置-20 ℃保存。
3.Eu3+-兔抗人IgG的制备 1 mg的兔抗人IgG加入含有1 mg的Eu3+-N2-[p-异氰酸-苄基]-二乙烯三胺四乙酸(Eu3+-DTTA)冻干粉的小瓶中, 25 ℃磁力搅拌反应20 h。反应液经用80 mmol/L三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲液(pH值7.8)平衡的Sepharose CL-6B柱(1 cm× 40 cm)层析, 控制流速为2 mL/min, 每管收集2 mL, 吸光度(280 nm)监测收集第一蛋白峰。
4.分析缓冲液的选择 制备4种不同的分析缓冲液:(1)0.05 mol/L磷酸盐缓冲液(PBS), pH值 7.0, 0.5% BSA, 0.01% NaN3, 0.1% Tween-20; (2)0.05 mol/L Tris-HCl, 余同(1); (3)pH值7.8, 余同(2); (4)pH值 7.8, 1% BSA, 余同(2)。用这4种不同的分析缓冲液分别进行TPO抗体-TRFIA, 测定每种情况下的信噪比[TPO抗体浓度为5 IU/mL的相应反应孔荧光计数(CPS)与零标准的CPS的比值]。
5. TPO抗体-间接TRFIA 在包被TPO抗原的微孔反应板中加入用分析缓冲液稀释的样本200 μ L, 25 ℃振荡1 h, 洗涤4次, 再加入200 μ L用分析缓冲液稀释的Eu3+-兔抗人IgG, 25 ℃振荡0.5 h, 洗涤4次, 再加入增强液200 μ L, 25 ℃振荡反应5 min后检测。该过程由DELFIA 1235全自动TRFIA检测仪自动完成。TPO抗体-TRFIA标准曲线分析[有效剂量(ED)、变异系数(CV)等]及结果由DELFIA 1235全自动TRFIA检测仪随机配备的Multicalc软件自动给出。
应用SPSS 12.0统计软件进行分析。
1.固相TPO抗原包被浓度 TPO抗原包被浓度分别为0.125、0.25、0.5、1.0、2.0、4.0、8.0 μ g/mL, 进行TPO抗体-TRFIA检测。结果显示, 从0.125~2.0 μ g/mL包被板检测最大特异结合率(Bmax)上升很大, 而从2.0~8.0 μ g/mL包被板检测Bmax没有明显升高。所以选择TPO抗原2.0 μ g/mL浓度包板, 已经达到良好的免疫反应的效果。
2.分析缓冲液的影响 结果显示(1)~(4)分析缓冲液的信噪比分别为2.99、3.33、3.47、3.94。PBS分析缓冲液的信噪比低于Tris-HCl分析缓冲液; 在Tris-HCl分析缓冲液中增大BSA的浓度或提高pH值, 均能提高信噪比。故本研究选择(4)作为分析缓冲液。
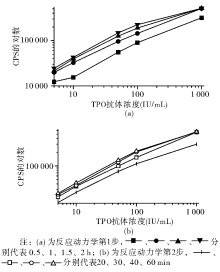
3.反应时间选择 采用两步法, 定第2步反应时间为30 min, 使第1步反应体系在25 ℃分别反应0.5、1、1.5、2 h, 结果见图1(a)。第1步反应时间为0.5 h时, 未完全反应; 1 h时, 标准曲线呈线性, 达到要求; 1.5和2 h时, 计数虽依次提高, 但高浓度点出现钩状效应(hook effect), 由此选定第1步反应时间为1 h。在第1步反应时间为1 h的条件下, 使第2步反应体系在25 ℃分别反应20、30、40、60 min, 结果见图1(b), 同理可推出第2步反应时间为30 min。因此以(1+0.5)h为本试剂盒的免疫反应时间。
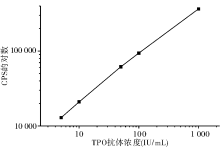
1.TPO抗体-TRFIA标准曲线 采用Log/Log_B 数学拟合模式。标准品含量对数值为横坐标, CPS的对数值为纵坐标, 绘制剂量-反应曲线, 见图2。方法学线性范围达1 000 IU/mL。以国家标准品为标准对照, 定标品实际浓度与标示浓度回归方程为Y= 1.013 2X-0.531 2, r=0.999 9(P< 0.05)。
2.敏感性 重复测定零剂量点20次, 以
3.线性试验 将TPO抗体浓度为201.36、573.41和1 279.03 IU/mL的3份血清进行倍比稀释, 经测定稀释倍数与样本含量呈线性关系, r分别为0.999 6、0.999 8和0.999 5(P< 0.05); 相关方程分别为Y=197.5X+5.408, Y=572.3X+3.979, Y=1 279.1X+12.889, 表明本方法具有良好的健全性。
4.精密度 取本实验室自配的低、中、高浓度TPO抗体质控冻干品各20份, 批内、批间(20例)实验数据见表1。
| 表1 批内、批间变异实验结果 |
5.基质效应 取含量为38.72 IU/mL TPO抗体血清分别加到50、100和1 000 IU/mL标准参考品中进行回收试验。回收率为98.85%、99.26%和98.55%, 平均回收率为98.89%。
6.稳定试验 将该试剂盒置于37 ℃ 7 d后与4 ℃保存的整套试剂盒双孔平行对比检测标准参考品, 结果相关性良好(Y=0.660 3X+7 263.2, r=0.996 7, P< 0.05)。
1.比对试验 用TPO抗体-TRFIA与电化学发光分析法(ECLIA)平行测定84例样本(其中36例甲状腺功能正常、24例甲状腺功能亢进症、24例甲状腺功能减退症), 结果2种方法之间相关性良好(Y=0.993 6X+3.401 7, r=0.983 2, P< 0.05)。
2.参考值范围的确定 252名健康人, 其甲状腺自身抗体阴性(包括甲状腺过氧化物酶抗体、甲状腺球蛋白抗体), 无甲状腺疾病史, 未触及甲状腺肿, 未服用除雌激素外的药物。采用所建方法测定上述252份样本, 结果取99%可信限, 取
3.临床验证 用本法测定153例甲状腺疾病患者血清样本(58例甲状腺功能亢进症、52例甲状腺功能减退症和43例甲状腺肿), 32例非甲状腺疾病患者血清样本(包括22例Ⅰ 型糖尿病患者, 10例风湿患者), 48例正常人血清样本。结果显示, 甲状腺功能亢进组和甲状腺功能减退组TPO抗体水平和阳性率显著高于其他组; 甲状腺肿组和非甲状腺疾病组TPO抗体水平与对照组比较, 差异有统计学意义(P均< 0.01)。不同试验组TPO抗体水平及其阳性率的比较见表2。
| 表2 不同试验组TPO抗体水平及其阳性率比较 |
国内TPO抗体检测主要采用放射免疫分析法(RIA)、酶联免疫吸附试验(ELISA)和ECLIA。RIA存在放射性污染、半衰期短及试剂盒稳定性差等问题。ELISA中酶标记物具有不稳定性, 且重复性和敏感性较差。ELISA和ECLIA的商品化试剂多为进口, 比较昂贵。本研究建立的TPO抗体-TRFIA具有特异性强、稳定性好、测定范围宽、操作简便、价廉等优点; 敏感性达1.0 IU/mL, 远高于ELISA(7 IU/mL, Siemens公司); 与ECLIA比对, 2种方法之间相关性良好(r=0.983 2), 与临床诊断的一致性好; 且从进口的全自动、半自动仪器到国产仪器都可以适用, 能满足从三级甲等医院到基层医院临床不同层次的需求。在国内填补了TPO抗体-TRFIA微量检测法的空白, 有良好的应用价值。
有报道, 将TPO的第590~675位氨基酸(C2)抗原区重组纯化用于固相包被, 65%的AITD患者血清中可以测到C2抗原的抗体[3], 但TPO抗体有IgG1、IgG2、IgG3和IgG4等亚型, 在健康人和AITD患者中各种亚型的分布有所不同, 此外患者和健康人体内TPO抗体的抗原结合位点及结合能力也有可能不同, 造成有些TPO抗体阳性患者的血清不能与C2区结合, 因此用全分子TPO可能更加理想。
当甲状腺发生病变, 滤泡细胞结构受到破坏时, TPO于甲状腺滤泡细胞腔的边缘即甲状腺细胞顶部向外周血溢漏, 刺激机体免疫系统产生抗甲状腺组织成分抗体即TPO抗体, 该抗体的产生与AITD有高度相关性[4]。本研究显示, 甲状腺功能亢进组和甲状腺功能减退组血清TPO抗体水平明显升高, 且阳性率较高, 与文献报道一致[5]; 在非甲状腺疾病患者中也可有轻至中度升高[6~8]。另外过多的碘摄入量也可能会影响甲状腺功能, 导致TPO抗体水平升高[9]。所以TPO抗体结果应与其他检验结果、全面的临床表现及其他可用的信息综合参考使用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|